Aricept: Inhibiteur de cholinestérase
Aricept est un médicament anticholinestérasique utilisé dans le traitement de la maladie d'Alzheimer. Infos détaillées sur l'utilisation, la posologie, les effets secondaires de Aricept.
Nom de marque: Aricept
Nom générique: Donepezil Hydrochloride
Aricept (donépézil) est un médicament Anticholinestérasique utilisé dans le traitement de la maladie d'Alzheimer. Infos détaillées sur les utilisations, la posologie et les effets secondaires d’Aricept ci-dessous.
La description
ARICEPT (chlorhydrate de donépézil) est un inhibiteur réversible de l'acétylcholinestérase, connu chimiquement comme (±) -2,3-dihydro-5,6-diméthoxy-2 - [[1- (phénylméthyl) -4-pipéridinyl] méthyl] -1 H-indén-1-one. Le chlorhydrate de donépézil est communément appelé dans la littérature pharmacologique comme E2020. Il a une formule empirique du type C24H29NO3HCl et un poids moléculaire de 415,96. Le chlorhydrate de donépézil est une poudre cristalline blanche et est librement soluble dans le chloroforme, soluble dans l'eau et dans l'acide acétique glacial, légèrement soluble dans l'éthanol et dans de l'acétonitrile et pratiquement insoluble dans l'acétate d'éthyle et de n-hexane.
ARICEPT est disponible pour l'administration orale sous forme de comprimés pelliculés contenant 5 ou 10 mg de chlorhydrate de donépézil. Les ingrédients inactifs sont le lactose monohydraté, l'amidon de maïs, la cellulose microcristalline, l'hydroxypropylcellulose, et du stéarate de magnésium. Le revêtement de film contient du talc, du polyéthylène glycol, de l'hypromellose et le dioxyde de titane. En outre, le comprimé 10 mg contient de l'oxyde de fer jaune (synthétique) en tant qu'agent de coloration.
Les comprimés ARICEPT ODT sont disponibles pour l'administration par voie orale. Chaque comprimé ARICEPT ODT contient 5 ou 10 mg de chlorhydrate de donépézil. Les ingrédients inactifs sont carraghénine, mannitel, le dioxyde de silicium colloïdal et l'alcool de polyvinyle. En outre, le comprimé 10 mg contient de l'oxyde de fer (jaune) comme agent de coloration.
Clinique Pharmacologie
Les théories actuelles sur la pathogénie des signes et des symptômes cognitifs de la maladie d'Alzheimer attribuent certains d'entre eux à une déficience de la neurotransmission cholinergique.
Le chlorhydrate de donépézil est postulé pour exercer son effet thérapeutique en améliorant la fonction cholinergique. Ceci est accompli en augmentant la concentration d'acétylcholine par inhibition réversible de son hydrolyse par l'acétylcholinestérase. Si ce mécanisme d'action proposé est correct, l'effet de donépézil peut diminuer à mesure que l'avancement du processus de la maladie et moins de neurones cholinergiques restent fonctionnellement intact. Il n'y a aucune preuve que le donépézil modifie le cours du processus de démence sous-jacent.
Données d'essais cliniques
L'efficacité de ARICEPT comme un traitement pour la maladie d'Alzheimer est démontrée par les résultats de deux, en double aveugle, les investigations cliniques randomisés contrôlés versus placebo chez des patients atteints de la maladie d'Alzheimer (diagnostiquée par NINCDS- et critères du DSM III-R, Mini-Mental State Examination â ‰ ¥ 10 et â ‰ ¤ 26 et clinique de la démence Évaluation de 1 ou 2). L'âge moyen des patients participant à des essais d’Aricept était de 73 ans, avec une gamme de 50 à 94. Environ 62% des patients étaient des femmes et 38% étaient des hommes. La répartition raciale était blanc 95%, noir 3% et d'autres races 2%.
Étude Mesures des résultats : Dans chaque étude, l'efficacité du traitement avec ARICEPT a été évaluée à l’aide d' une stratégie de double évaluation des résultats.
La capacité des ARICEPT pour améliorer la performance cognitive a été évaluée avec la sous-échelle cognitive de la maladie Échelle d'évaluation de la maladie d'Alzheimer (ADAS-cog), un instrument multi-élément qui a été largement validé dans les cohortes longitudinales des patients maladie d'Alzheimer. L’ADAS-cog examine les aspects de la performance cognitive, y compris des éléments de la mémoire, l'orientation, l'attention, le raisonnement, le langage et praxis choisi. La gamme de notation ADAS-cog est de 0 à 70, les scores plus élevés indiquant une plus grande déficience cognitive. adultes normaux âgés peuvent marquer aussi bas que 0 ou 1, mais il est pas rare pour les adultes non déments pour marquer légèrement plus élevé.
Les patients recrutés comme participants dans chaque étude avaient des scores moyens sur la maladie échelle d'évaluation de la maladie d'Alzheimer (ADAS-cog) d'environ 26 unités, avec une gamme de 4 à 61. L'expérience acquise dans des études longitudinales de patients ambulatoires atteints de légère à modérée de la maladie d'Alzheimer suggère qu'ils gagnent 6-12 unités par an sur l’ADAS-cog. Toutefois, des degrés moindres de changement sont observés chez les patients avec une maladie très doux ou très avancé, car l'ADAS-cog n’est pas uniformément sensible à changer au cours de la maladie. Le taux annualisé de baisse des patients sous placebo participant à des essais d’Aricept était d'environ 2 à 4 unités par an.
La capacité de ARICEPT pour produire un effet clinique global a été évalué à l'aide Interview Based Impression d'un Clinicien du changement qui a nécessité l'utilisation de l'information des aidants naturels, CIBIC plus. Le CIBIC plus n'est pas un seul instrument et non un instrument normalisé comme le ADAS-cog. Les essais cliniques de médicaments expérimentaux ont utilisé une variété de formats CIBIC, toutes différentes en termes de profondeur et de la structure.
À ce titre, les résultats d'un CIBIC ainsi que reflètent l'expérience clinique de l'essai ou des essais dans lesquels il a été utilisé et ne peut être comparé directement avec les résultats de CIBIC plus les évaluations d'autres essais cliniques. Le CIBIC ainsi utilisé dans les essais de Aricept était un instrument semi-structuré qui était destiné à examiner quatre grands domaines de la fonction du patient: Général, cognitives, comportementales et activités de la vie quotidienne. Il représente l'évaluation d'un clinicien qualifié en fonction de son / ses observations lors d'une entrevue avec le patient, en combinaison avec les informations fournies par un fournisseur de soins familiers avec le comportement du patient sur l'intervalle nominal. Le CIBIC plus est marqué en tant que sept points note catégorique, allant d'un score de 1, indiquant "nettement améliorée," à un score de 4, indiquant «aucun changement» à un score de 7, en indiquant "nettement pire." Le plus de CIBIC n'a pas été systématiquement comparées directement à des évaluations de ne pas utiliser des informations de soignants (CIBIC) ou d'autres méthodes globales.
Trente-semaine d'étude
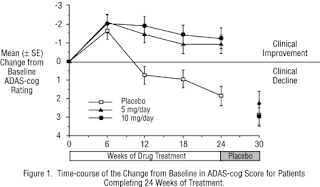
Dans une étude d'une durée de 30 semaines, 473 patients ont été randomisés pour recevoir des doses uniques quotidiennes de placebo, 5 mg / jour ou 10 mg / jour de ARICEPT. L'étude de 30 semaines a été divisée en une phase de traitement actif de 24 semaines en double aveugle suivie d'une simple aveugle période placebo lavage de 6 semaines. L'étude a été conçue pour comparer 5 mg / jour ou 10 mg / jour doses fixes de ARICEPT au placebo. Cependant, pour réduire la probabilité d'effets cholinergiques, le traitement / jour à 10 mg a été démarré après un traitement initial de 7 jours avec des doses de 5 mg / jour.
Effets sur l'ADAS-cog : La figure 1 illustre le cours du temps pour le changement de base dans les scores ADAS-cog pour les trois groupes de dose au cours des 30 semaines de l'étude. Après 24 semaines de traitement, les scores de changement les différences moyennes dans les ADAS-cog pour ARICEPT patients traités par rapport aux patients sous placebo étaient de 2,8 et 3,1 unités pour le 5 mg / jour et traitements 10 mg / jour, respectivement. Ces différences étaient statistiquement significatives. Bien que la taille de l’effet du traitement peut sembler être légèrement supérieure pour le traitement / jour à 10 mg, il n'y avait aucune différence statistiquement significative entre les deux traitements actifs.
Après 6 semaines de fiasco de placebo, les scores de l'ADAS-cog pour les deux groupes de traitement d’Aricept étaient impossibles à distinguer de ces patients qui avaient reçu seulement le placebo pendant 30 semaines. Cela donne à penser que les effets bénéfiques de ARICEPT® Abate de plus de 6 semaines après l'arrêt du traitement et ne représentent pas un changement dans la maladie sous-jacente. Il n'y avait aucune preuve d'un effet de rebond 6 semaines après l'arrêt brusque du traitement.
La figure 2 illustre les pourcentages cumulatifs de patients de chacun des trois groupes de traitement ayant atteint la mesure de l'amélioration du score ADAS-cog représenté sur l'axe des abscisses. Trois scores de changement, (7 points et 4 points réductions de référence ou pas de changement dans le score) ont été identifiés à titre d'illustration et pour cent des patients dans chaque groupe pour atteindre ce résultat est indiqué dans le tableau encadré.
Les courbes démontrent que les deux patients assignés au placebo et ARICEPT® ont un large éventail de réponses, mais que les groupes de traitement actifs sont plus susceptibles de montrer les plus grandes améliorations. Une courbe d'un traitement efficace serait déplacé vers la gauche de la courbe pour le groupe placebo, tandis qu'un traitement inefficace ou délétère serait superposé à, ou décalé vers la droite de la courbe pour le groupe placebo, respectivement.
Les effets sur le CIBIC ainsi que : la figure 3 est un histogramme de la distribution de fréquence des scores obtenus CIBIC ainsi que par des patients affectés à chacun des trois groupes de traitement qui ont terminé les 24 semaines de traitement. Les différences moyennes drogue placebo pour ces groupes de patients étaient 0,35 unités et 0,39 unités pour 5 mg / jour et 10 mg / jour de ARICEPT, respectivement. Ces différences étaient statistiquement significatives. Il n'y avait aucune différence statistiquement significative entre les deux traitements actifs.
Quinze semaines d'étude
Dans une étude de 15 semaines la durée, les patients ont été randomisés pour recevoir des doses quotidiennes uniques de placebo ou 5 mg / jour ou 10 mg / jour de ARICEPT pendant 12 semaines, suivie d'une période de fiasco de placebo de 3 semaines. Comme dans l'étude de 30 semaines, pour éviter les effets cholinergiques aigus, le traitement / jour 10 mg suivie d'un traitement initial de 7 jours avec des doses de 5 mg / jour.
Effets sur l'ADAS-Cog : La figure 4 illustre l'évolution temporelle du changement de base des scores ADAS-cog pour les trois groupes de dose au cours des 15 semaines de l'étude. Après 12 semaines de traitement, les différences de ADAS-Cog changement des scores moyens pour les patients Aricept traités par rapport aux patients sous placebo étaient de 2,7 et 3,0 unités chacun, pour les groupes de traitement d'ARICEPT 5 et 10 mg / jour, respectivement. Ces différences étaient statistiquement significatives. La taille de l’effet pour le groupe / jour 10 mg peut sembler être légèrement supérieur à celui de 5 mg / jour. Toutefois, les différences entre les traitements actifs ne sont pas statistiquement significatives.
Après 3 semaines de fiasco de placebo, les scores de l'ADAS-cog pour les deux groupes de traitement d’ARICEPT ont augmenté, ce qui indique que l'arrêt de l’ARICEPT a entraîné une perte de son effet de traitement. La durée de cette période de sevrage placebo n'a pas été suffisante pour caractériser le taux de perte de l'effet du traitement, mais l'étude de 30 semaines (voir ci-dessus) a démontré que les effets du traitement associés à l'utilisation d’ARICEPT Abate dans les 6 semaines de l'arrêt du traitement.
La figure 5 illustre les pourcentages cumulatifs de patients de chacun des trois groupes de traitement qui ont atteint la mesure d'amélioration du score ADAS-cog montré sur l'axe des X. Les trois mêmes scores de changement, (7 points et 4 points réductions de référence ou pas de changement dans le score) comme sélectionné pour l'étude de 30 semaines ont été utilisées pour cette illustration. Les pourcentages de patients ayant obtenu ces résultats sont présentés dans le tableau encadré.
Comme observé dans l'étude de 30 semaines, les courbes démontrent que les patients assignés au placebo ou à ARICEPT® ont un large éventail de réponses, mais que le ARICEPT® patients traités est plus susceptible de présenter les plus grandes améliorations dans les performances cognitives.
Les effets sur le CIBIC ainsi que : la figure 6 est un histogramme de la distribution de fréquence des scores obtenus CIBIC ainsi que par des patients affectés à chacun des trois groupes de traitement qui ont terminé les 12 semaines de traitement. Les différences dans les scores moyens pour ARICEPT patients traités par rapport aux patients sous placebo à la semaine 12 étaient 0,36 et 0,38 unités pour le 5 mg / jour et les groupes de 10 mg / jour de traitement, respectivement. Ces différences étaient statistiquement significatives.
Dans les deux études, l'âge du patient, le sexe et la race sont introuvables de prédire l'issue clinique du traitement ARICEPT.
Pharmacokinetics clinique
ARICEPT ODT est bioéquivalent à Aricept comprimés. Le donépézil est bien absorbée avec une biodisponibilité orale relative de 100% et atteint des concentrations plasmatiques maximales en 3 à 4 heures. Les pharmacokinetics sont linéaires sur une gamme de dose de 1-10 mg une fois par jour. Ni nourriture, ni le temps d'administration (matin par rapport à la dose du soir) n’influe sur le taux ou le degré d'absorption d’Aricept comprimés. Une étude de l'effet de la nourriture n'a pas été menée avec ARICEPT ODT, devrait toutefois l'effet de la nourriture avec ARICEPT ODT être minime. ARICEPT ODT peut être pris sans égard aux repas.
La demi-vie d'élimination du donépézil est d'environ 70 heures et la clairance plasmatique apparente moyenne (Cl / F) est de 0,13 L / h / kg. Après administration de doses multiples, donepezil accumule dans le plasma par 4-7 fois et l'état d'équilibre est atteint dans les 15 jours. Le volume de l'état d'équilibre de la distribution est de 12 L / kg. Le donépézil est d'environ 96% lié aux protéines plasmatiques humaines, principalement pour les albumines (environ 75%) et alpha1 - glycoprotéine acide (environ 21%) sur la plage de concentration de 2-1000 ng / mL.
Le donépézil est à la fois excrété dans l'urine intacte et largement métabolisé en quatre métabolites majeurs, dont deux sont connus pour être actifs, et un certain nombre de métabolites mineurs, dont tous n'ont été identifiés. Le donépézil est métabolisé par le CYP 450 isoenzymes 2D6 et 3A4 et subit une glucuronidation. Après administration de 14C marqué par le donépézil, la radioactivité du plasma, exprimée en pour cent de la dose administrée, est présente essentiellement comme donépézil intacte (53%) et que la 6-O-desméthyl donépézil (11%), qui a été rapportée inhiber l'acétylcholinestérase dans la même mesure que le donépézil in vitro et a été trouvée dans le plasma à une concentration égale à environ 20% de donépézil. Environ 57% et 15% de la radioactivité totale a été retrouvée dans les urines et les fèces, respectivement, sur une période de 10 jours, tandis que 28% sont restés non récupéré, avec environ 17% de la dose de donépézil récupérée dans l'urine sous forme inchangée.
Populations particulières:
Maladie hépatique: Dans une étude de 11 patients atteints de cirrhose alcoolique stable, la clairance de l’ARICEPT a diminué de 20% par rapport à 11 ans en bonne santé et des sujets de sexe appariés.
Maladie rénale: Dans une étude de 11 patients avec insuffisance rénale modérée à sévère (ClCr <18 mL / min / 1,73 m2) à l'apurement des ARICEPT ne différait pas de 11 ans et le sexe adapté sujets sains.
Âge: Aucune étude pharmacocinétique formelle n’a été menée pour examiner les différences d'âge liées à la pharmacocinétique de l’ARICEPT. Cependant, les concentrations moyennes d’Aricept plasmatique mesurées pendant le contrôle thérapeutique du médicament chez des patients âgés atteints de la maladie d'Alzheimer sont comparables à ceux observés chez les jeunes volontaires sains.
Genre et Race: Aucune étude pharmacocinétique spécifique a été réalisée pour étudier les effets du sexe et de la race sur la disposition de ARICEPT. Cependant, l'analyse pharmacocinétique rétrospective indique que le sexe et la race (japonais et Caucasiens) n'a pas affecté la clairance de la ARICEPT.
Interactions médicamenteuses
Médicaments fortement liés aux protéines plasmatiques: études de déplacement de drogues ont été réalisées in vitro entre ce médicament fortement lié (96%) et d'autres médicaments tels que le furosémide, la digoxine, la warfarine. ARICEPT à des concentrations de 0,3 à 10 mg / ml n'a pas affecté la liaison du furosémide (5 mg / ml), de la digoxine (2 ng / ml) et la warfarine (3 mg / mL) à l'albumine humaine. De même, la liaison d’ARICEPT à l'albumine humaine n'a pas été affectée par le furosémide, la digoxine et la warfarine.
Effet d'ARICEPT sur le métabolisme d'autres médicaments: Non in vivo des essais cliniques ont étudié l'effet d’ARICEPT sur la clairance des médicaments métabolisés par le CYP 3A4 (par exemple, cisapride, terfénadine) ou par CYP 2D6 (par exemple, imipramine). Cependant, des études in vitro montrent un taux de liaison à ces enzymes faible (moyenne Ki environ 50-130 mM), que, étant donné les concentrations plasmatiques thérapeutiques de donepezil (164 nM), indique peu de chances d'interférence.
Si ARICEPT a un risque quelconque de l'induction enzymatique est inconnue.
Les études pharmacocinétiques formelles ont évalué le potentiel d’ARICEPT pour l'interaction avec la théophylline, la cimétidine, la warfarine, la digoxine et le kétoconazole. Aucun effet d’ARICEPT sur la pharmacocinétique de ces médicaments n’a été observé.
Effet des autres médicaments sur le métabolisme des ARICEPT: kétoconazole et la quinidine, les inhibiteurs de CYP450, 3A4 et 2D6, respectivement, inhibent le métabolisme du donépézil in vitro. Qu'il y ait un effet clinique de quinidine est pas connue. Dans une étude de 7 jours croisé dans 18 volontaires en bonne santé, le kétoconazole (200 mg qd) a augmenté signifie donépézil (5 mg qd) concentration (ASC0-24 et la Cmax) de 36%. La pertinence clinique de cette augmentation de la concentration est inconnue.
Inducteurs du CYP 2D6 et CYP 3A4 (par exemple, la phénytoïne, la carbamazépine, la dexaméthasone, la rifampicine et le phénobarbital) pourrait augmenter le taux d'élimination des ARICEPT.
Des études pharmacocinétiques formelles ont montré que le métabolisme d’ARICEPT n'a pas été significativement affecté par l'administration simultanée de la digoxine ou la cimétidine.
Indications et utilisation
ARICEPT est indiqué pour le traitement de la démence légère à modérée de type Alzheimer.
Contre-indications
ARICEPT est contre-indiqué chez les patients présentant une hypersensibilité connue au chlorhydrate de donépézil ou des dérivés de pipéridine.
Avertissements
Anesthésie : ARICEPT, comme un inhibiteur de la cholinestérase, est susceptible d'amplifier la relaxation musculaire de type succinylcholine lors d'une anesthésie.
Conditions cardiovasculaires : En raison de leur action pharmacologique, les inhibiteurs de la cholinestérase peuvent avoir des effets vagotoniques sur les nœuds sinusal et auriculo - ventriculaires. Cet effet peut se manifester par une bradycardie ou un bloc cardiaque chez les patients avec et sans anomalies connues de la conduction cardiaque sous - jacents. Syncopes ont été signalés en association avec l'utilisation de ARICEPT
Conditions gastro - intestinales : Grâce à leur action primaire, inhibiteurs du cholinestérase peuvent être attendus pour augmenter la sécrétion d'acide gastrique due à une augmentation de l’activité cholinergique. Par conséquent, les patients doivent être étroitement surveillés pour des symptômes d'hémorragie gastro - intestinale active ou occulte, en particulier ceux à risque accru de développer des ulcères, par exemple, ceux ayant des antécédents de maladie ulcéreuse ou recevant des médicaments anti-inflammatoires non stéroïdiens (AINS) simultanés. Les études cliniques d’ARICEPT n’ont montré aucune augmentation, par rapport au placebo, l'incidence de la maladie soit ulcère gastroduodénal ou une hémorragie gastro - intestinale.
ARICEPT, en conséquence prévisible de ses propriétés pharmacologiques, a été montré que la diarrhée, des nausées et des vomissements. Ces effets, quand ils se produisent, apparaissent plus fréquemment avec la dose / jour 10 mg qu'avec la dose de 5 mg / jour. Dans la plupart des cas, ces effets ont été légers et transitoires, parfois une durée d'une à trois semaines, et ont résolu lors de l'utilisation continue de ARICEPT.
Genitourinary : Bien que non observée dans les essais cliniques d’ARICEPT, les cholinomimétiques peuvent provoquer une obstruction de sortie de la vessie.
Conditions neurologiques : Convulsions: les cholinomimétiques sont soupçonnés d'avoir un certain potentiel pour provoquer des convulsions généralisées. Cependant, l’activité de saisie peut aussi être une manifestation de la maladie d'Alzheimer.
Conditions pulmonaires : En raison de leurs actions cholinomimétiques, lesinhibiteurs de la cholinestérase doivent être prescrits avec précaution chez les patients ayant des antécédents d'asthme ou de maladie pulmonaire obstructive.
Précautions
Interactions médicamenteuses (voir Pharmacologie clinique: Clinical Pharmacokinetics: Interactions médicamenteuses)
Effet de ARICEPT sur le métabolisme d'autres médicaments: Non in vivo des essais cliniques ont étudié l'effet d’ARICEPT sur la clairance des médicaments métabolisés par le CYP 3A4 (par exemple, cisapride, terfénadine) ou par CYP 2D6 (par exemple, imipramine). Cependant, des études in vitro montrent un taux de liaison à ces enzymes faible (moyenne Ki environ 50-130 mM), que, étant donné les concentrations plasmatiques thérapeutiques de donepezil (164 nM), indique peu de chances d'interférence.
Si ARICEPT a un risque quelconque de l'induction enzymatique est inconnu.
Les études pharmacocinétiques formelles ont évalué le potentiel d’ARICEPT® pour l'interaction avec la théophylline, la cimétidine, la warfarine, la digoxine et le kétoconazole. Aucun effet d’ARICEPT sur la pharmacocinétique de ces médicaments a été observé.
Effet des autres médicaments sur le métabolisme d'ARICEPT : kétoconazole et la quinidine, les inhibiteurs de CYP450, 3A4 et 2D6, respectivement, inhibent lemétabolisme du donépézil in vitro. Qu'il y ait un effet clinique de quinidine est pas connue. Dans une étude de 7 jours croisé dans 18 volontaires en bonne santé, lekétoconazole (200 mg qd) a augmenté signifie donépézil (5mg QD) concentrations (AUC0-24 et Cmax) de 36%. La pertinence clinique de cette augmentation de la concentration est inconnue.
Inducteurs du CYP 2D6 et CYP 3A4 (par exemple, la phénytoïne, la carbamazépine, la dexaméthasone, la rifampicine et le phénobarbital) pourrait augmenter le taux d'élimination des ARICEPT.
Des études pharmacocinétiques formelles ont montré que le métabolisme d’ARICEPT n'a pas été significativement affecté par l'administration simultanée de la digoxine ou la cimétidine.
Utilisation avec anticholinergiques : En raison de leur mécanisme d'action, les inhibiteurs du cholinestérase ont le potentiel d'interférer avec l'activité des anticholinergiques.
Utilisation avec cholinomimétiques et autres inhibiteurs du cholinestérase: Un effet synergique peut être prévu lorsque les inhibiteurs du cholinestérase sont donnés en même temps que la succinylcholine, les agents bloquants neuromusculaires similaires ou agonistes cholinergiques tels que le béthanéchol.
Carcinogenesis, Mutagenesis, Affaiblissement de Fertilité
Aucune preuve d'un potentiel cancérigène a été obtenu dans une étude de cancérogénicité 88 semaines de chlorhydrate de donépézil réalisée en souris CD-1 à des doses allant jusqu'à 180 mg / kg / jour (environ 90 fois la dose maximale recommandée chez l'humain sur une / m2 mg) , ou dans une étude de cancérogénicité de 104 semaines chez des rats Sprague-Dawley à des doses allant jusqu'à 30 mg / kg / jour (environ 30 fois la dose maximale recommandée chez l'humain sur une base mg / m2).
Le donépézil n'a pas été mutagène dans le test de mutation inverse d'Ames dans les bactéries, ou dans un lymphome de souris test de mutation in vitro. Dans le test d'aberration chromosomique dans des cultures de poumon de hamster chinois (CHL) des cellules, des effets clastogènes ont été observés. Donépézil n'a pas été clastogène dans le test in vivo du micronoyau de souris et n'a pas été génotoxique dans un imprévu test de synthèse d'ADN in vivo chez le rat.
Donépézil n'a eu aucun effet sur la fertilité chez le rat à des doses allant jusqu'à 10 mg / kg / jour (environ 8 fois la dose maximale recommandée chez l'humain sur une base mg / m2).
Grossesse
Grossesse Catégorie C : études de tératologie menées chez des rates gravides à des doses allant jusqu'à 16 mg / kg / jour (environ 13 fois la dose maximale recommandée chez l’humain sur une / m2 mg) et chez les lapins enceintes aux doses allant jusqu'à 10 mg / kg / jour (environ 16 fois la dose maximale recommandée chez l’humain sur une / m2 mg) n'a pas révélé aucun élément de preuve pour un potentiel tératogène de donépézil. Cependant, dans une étude dans laquelle des rats enceintes ont reçu jusqu'à 10 mg / kg / jour (environ 8 fois la dose maximale recommandée chez l’humain sur une / m2 mg) du jour 17 de la gestation au jour 20 post - partum, il y avait une légère augmentation des naissances fixes et une légère diminution de la survie des petits au jour 4 post -partum à cette dose; la plus faible dose testée suivant était de 3 mg / kg / jour. Il n'y a pas d’études adéquates ou bien contrôlées chez les femmes enceintes. ARICEPT® doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Mères infirmières
On ne sait pas si le donépézil est excrété dans le lait maternel humain. ARICEPT a aucune indication pour une utilisation chez les mères allaitantes.
Utilisation de pédiatrie
Il n'y a pas d'essais adéquates et bien contrôlées afin de documenter la sécurité et l'efficacité de ARICEPT dans toute maladie survenant chez les enfants.
Utilisation gériatrique
La maladie d'Alzheimer est une maladie survenant principalement chez les personnes de plus de 55 ans. L'âge moyen des patients inclus dans les études cliniques avec ARICEPT® était de 73 ans; 80% de ces patients étaient âgés entre 65 et 84 ans et 49% des patients étaient égaux ou supérieurs à l'âge de 75 ans Les données d'efficacité et de sécurité présentées dans la section des essais cliniques ont été obtenus à partir de ces patients. Il y avait des différences significatives dans la plupart des événements indésirables signalés par les groupes de patients â ‰ ¥ 65 ans et <65 ans cliniquement.
Effets indésirables
Événements indésirables Menant à la Cessation
Les taux de cessation des essais cliniques contrôlés de ARICEPT en raison d'événements indésirables pour les groupes de traitement ARICEPT / jour 5 mg étaient comparables à ceux des groupes placebo-traitement à environ 5%. Le taux d'abandon des patients ayant reçu escalades de 7 jours à partir de 5 mg / jour à 10 mg / jour, était supérieure à 13%.
Les événements indésirables les plus fréquents ayant entraîné l'arrêt, définis comme ceux qui se produisent dans au moins 2% des patients et à deux fois l'incidence observée chez les patients sous placebo, sont présentés dans le tableau 1.
|
Tableau 1. Effets indésirables les plus
fréquents conduisant à Retrait
des essais cliniques contrôlés par groupe Dose |
|||
|
Groupe dose
|
Placebo
|
5 mg / ARICEPT jour
|
10 mg / ARICEPT jour
|
|
Les patients randomisés
|
355
|
350
|
315
|
|
Événement /% Abandon d'
|
|||
|
La nausée
|
1%
|
1%
|
3%
|
|
La diarrhée
|
0%
|
<1%
|
3%
|
|
Vomissement
|
<1%
|
<1%
|
2%
|
Événements cliniques indésirables les plus fréquentes Vus en association avec l'utilisation de ARICEPT
Les événements indésirables les plus communs, définis comme ceux qui se produisent à une fréquence d'au moins 5% chez les patients recevant 10 mg / jour et deux fois le taux de placebo, sont largement prédit par les effets cholinomimétiques de Aricept. Ceux-ci incluent la nausée, la diarrhée, l'insomnie, des vomissements, des crampes musculaires, la fatigue et l'anorexie. Ces événements indésirables sont souvent d'intensité légère et transitoire, la résolution au cours du traitement d’ARICEPT continue sans la nécessité d'une modification de dose.
Il existe des preuves pour suggérer que la fréquence de ces événements indésirables communes peut être affectée par le taux de titration. Une étude ouverte a été menée auprès de 269 patients ayant reçu un placebo dans les études 15 et 30 semaines. Ces patients ont été titrés à une dose de 10 mg / jour pendant une période de 6 semaines. Les taux d'événements indésirables fréquents étaient inférieurs à ceux observés chez les patients titrés à 10 mg / jour pendant une semaine dans les essais cliniques contrôlés et étaient comparables à ceux observés chez les patients de 5 mg / jour.
Voir le tableau 2 pour une comparaison des événements indésirables les plus communs suivants une et six semaines schémas de titrage.
|
Tableau 2. Comparaison des taux d'effets
indésirables chez les patients
titré à 10 mg / jour pendant 1 à 6 semaines |
||||
|
|
Pas de titration
|
Une semaine titrage
|
Six semaines titrage
|
|
|
Événement indésirable
|
Placebo (n = 315)
|
5 mg / jour (n = 311)
|
10 mg / jour (n = 315)
|
10 mg / jour (n = 269)
|
|
La nausée
|
6%
|
5%
|
19%
|
6%
|
|
La diarrhée
|
5%
|
8%
|
15%
|
9%
|
|
Insomnie
|
6%
|
6%
|
14%
|
6%
|
|
Fatigue
|
3%
|
4%
|
8%
|
3%
|
|
Vomissement
|
3%
|
3%
|
8%
|
5%
|
|
Crampes
musculaires
|
2%
|
6%
|
8%
|
3%
|
|
Anorexie
|
2%
|
3%
|
7%
|
3%
|
Effets indésirables signalés dans les essais contrôlés
Les événements cités reflètent l'expérience acquise dans des conditions étroitement contrôlées des essais cliniques dans une population de patients très sélectionnés. Dans la pratique clinique réelle ou dans d'autres essais cliniques, ces estimations de fréquence ne peuvent pas appliquer, comme les conditions d'utilisation, le comportement des rapports, et les types de patients traités peuvent différer. Le tableau 3 présente le traitement des signes et symptômes émergents qui ont été signalés dans au moins 2% des patients dans les essais contrôlés par placebo qui ont reçu ARICEPT et pour lesquels le taux d'apparition était plus importante pour ARICEPT affecté que les patients du groupe placebo-attribué. En général, les événements indésirables survenus plus fréquemment chez les femmes et avec l'âge.
|
Tableau 3. Effets indésirables
signalés dans les essais cliniques contrôlés
chez au moins 2% des patients recevant ARICEPT ® et à une fréquence supérieure que les patients traités par placebo |
||
|
Système de Corps / Événement indésirable
|
Placebo
(N = 355)
|
ARICEPT ®
(N = 747)
|
|
Pour cent des patients avec un événement indésirable
|
72
|
74
|
|
Corps entier
|
||
|
Mal de
tête
|
9
|
dix
|
|
Douleur,
divers endroits
|
8
|
9
|
|
Accident
|
6
|
7
|
|
Fatigue
|
3
|
5
|
|
Système cardiovasculaire
|
||
|
Syncope
|
1
|
2
|
|
Système digestif
|
||
|
La nausée
|
6
|
11
|
|
La
diarrhée
|
5
|
dix
|
|
Vomissement
|
3
|
5
|
|
Anorexie
|
2
|
4
|
|
Système sanguin et lymphatique
|
||
|
Ecchymose
|
3
|
4
|
|
Métaboliques et nutritionnels Systèmes
|
||
|
Poids
Diminution
|
1
|
3
|
|
Système musculo-squelettique
|
||
|
Crampes
musculaires
|
2
|
6
|
|
Arthrite
|
1
|
2
|
|
Système nerveux
|
||
|
Insomnie
|
6
|
9
|
|
Vertiges
|
6
|
8
|
|
Dépression
|
<1
|
3
|
|
rêves
anormaux
|
0
|
3
|
|
Somnolence
|
<1
|
2
|
|
système urogénital
|
||
|
Urination
fréquente
|
1
|
2
|
Autres effets indésirables observés pendant les essais cliniques
ARICEPT a été administré à plus de 1700 personnes au cours des essais cliniques dans le monde entier. Environ 1200 de ces patients ont été traités pendant au moins 3 mois et plus de 1000 patients ont été traités pendant au moins 6 mois. Contrôlé et des essais non contrôlés aux États-Unis ont inclus environ 900 patients. En ce qui concerne la dose maximale de 10 mg / jour, cette population comprend 650 patients traités pendant 3 mois, 475 patients traités pendant 6 mois et 116 patients traités pendant plus de 1 an. La gamme de l'exposition des patients est de 1 à 1214 jours.
Traitement des signes émergents et les symptômes qui se sont produits au cours de 3 essais cliniques contrôlés et deux essais ouverts aux États-Unis ont été enregistrées comme des événements indésirables par les investigateurs cliniques utilisant la terminologie de leur choix. Pour fournir une estimation globale de la proportion d'individus ayant les types d'événements similaires, les événements ont été regroupés en un plus petit nombre de catégories standardisées en utilisant un dictionnaire COSTART modifié et la fréquence des événements ont été calculées dans toutes les études. Ces catégories sont utilisées dans la liste ci-dessous. Les fréquences représentent la proportion de 900 patients de ces essais qui ont vécu cet événement tout en recevant ARICEPT®. Tous les événements indésirables survenant au moins deux fois sont inclus, sauf pour ceux qui figurent déjà dans les tableaux 2 ou 3, les termes COSTART trop généraux pour être informative, ou d'événements moins susceptibles d'être médicament a causé. Les événements sont classés par système de corps et énumérés en utilisant les définitions suivantes: les effets indésirables fréquents - ceux qui se produisent dans 1/100 patients; événements indésirables rares - ceux qui se produisent dans 1/100 avec les patients 1/1000. Ces effets indésirables ne sont pas nécessairement liés au traitement ARICEPT et dans la plupart des cas ont été observés à une fréquence similaire chez les patients traités par placebo dans les études contrôlées. Aucuns événements indésirables supplémentaires importants n’ont été observés dans des études réalisées à l'extérieur des États-Unis.
Corps dans l'ensemble: Fréquent: la grippe, des douleurs thoraciques, maux de dents; Rare: fièvre, œdème facial, œdème périorbitaire, hernie hiatale, abcès, cellulite, des frissons, la froideur généralisée, la tête de plénitude, de l’apathie.
Système cardiovasculaire : Fréquent: hypertension, vasodilatation, fibrillation auriculaire, les bouffées de chaleur, hypotension; Rare: l’angine de poitrine, hypotension orthostatique, infarctus du myocarde, un bloc AV (premier degré), l'insuffisance cardiaque congestive, artérite, bradycardie, maladie vasculaire périphérique, la tachycardie supraventriculaire, la thrombose veineuse profonde.
Système digestif : Fréquent: incontinence fécale, hémorragie gastro - intestinale, des ballonnements, des douleurs épigastriques; Rare: éructation, gingivite, augmentation de l' appétit, flatulence, abcès parodontal, lithiase biliaire, la diverticulite, la bave, la bouche sèche, la fièvre des maux, la gastrite, du côlon irritable, œdème de la langue, douleurs épigastriques, la gastro - entérite, augmentation des transaminases, les hémorroïdes, iléus, augmentation de la soif, la jaunisse , méléna, polydipsie, ulcère duodénal, l' ulcère de l' estomac.
Système endocrinien : Rare: diabète sucré, le goitre.
Système sanguin et lymphatique : Rare: anémie, thrombocytémie, thrombocytopénie, éosinophilie, érythrocytopénie.
Troubles métaboliques et nutritionnels : Fréquent: déshydratation; Rare: la goutte, l’hypokaliémie, augmentation de la créatine kinase, l’hyperglycémie, augmentation de poids, augmentation du lactate déshydrogénase.
Appareil locomoteur : Fréquents: fracture de l' os; Faiblesse musculaire, fasciculation musculaire: Infrequent.
Système nerveux: fréquents : délires, tremblements, irritabilité, paresthésie, agressivité, vertiges, ataxie, augmentation de la libido, agitation, pleurs anormaux, la nervosité, l' aphasie; Rare: accident vasculaire cérébral, hémorragie intracrânienne, accident ischémique transitoire, labilité émotionnelle, lesnévralgies, la froideur (localisée), spasmes musculaires, dysphorie, démarche anormale, hypertonie, hypokinésie, névrodermite, engourdissement (localisée), laparanoïa, la dysarthrie, la dysphasie, l' hostilité, a diminué libido, mélancolie, retrait émotionnel, nystagmus, la stimulation.
Système respiratoire : Fréquent: dyspnée, maux de gorge, la bronchite; Rare: épistaxis, égouttement nasal de poteau, la pneumonie, l' hyperventilation, une congestion pulmonaire, une respiration sifflante, l’hypoxie, la pharyngite, la pleurésie, l' effondrement pulmonaire, l' apnée du sommeil, le ronflement.
Peau et Appendices : Fréquent: prurit, hypersudation, urticaire; Rare: dermatite, érythème, décoloration de la peau, hyperkératose, alopécie, dermatite fongique, l'herpès zoster, hirsutisme, vergetures, sueurs nocturnes, l’ulcère de la peau.
Sens : Fréquent: la cataracte, une irritation des yeux, vision floue; Rare: sécheresse oculaire, le glaucome, otalgie, acouphène, blépharite, diminution de l'audition, hémorragie rétinienne, otite externe, otite moyenne, mauvais goût, hémorragie conjonctivale, bourdonnement d' oreille, le mal des transports, des taches devant les yeux.
Système urogénital : Fréquent: incontinence urinaire, la nycturie; Rare: dysurie, hématurie, l’urgence urinaire, métrorragies, cystite, énurésie, hypertrophie de la prostate, la pyélonéphrite, l’incapacité de la vessie vide, fibroadenosis du sein, du sein fibrokystique, mammite, pyurie, l’insuffisance rénale, la vaginite.
Rapports Postintroduction
Les rapports volontaires d'événements indésirables temporellement associés à ARICEPT qui ont été reçus depuis l'introduction du marché qui ne sont pas énumérés ci-dessus, et qu'il n'y a des données insuffisantes pour déterminer le lien de causalité avec le médicament sont les suivants: douleur abdominale, agitation, cholécystite, confusion, convulsions, hallucinations, bloc cardiaque (tous types), anémie hémolytique, hépatite, hyponatrémie, syndrome malin des neuroleptiques, pancréatite, et éruption cutanée.
Dose excessive
Parce que les stratégies pour la gestion de surdosage sont en constante évolution, il est conseillé de contacter un centre antipoison pour déterminer les dernières recommandations pour la gestion d'un surdosage de tout médicament.
Comme dans tous les cas de surdosage, les mesures générales de soutien devraient être utilisées. Surdosage avec des inhibiteurs du cholinestérase peut entraîner une crise cholinergique caractérisée par des nausées, des vomissements, salivation, transpiration, bradycardie, hypotension, dépression respiratoire, un collapsus et des convulsions. L'augmentation de la faiblesse musculaire est une possibilité et peut entraîner la mort si les muscles respiratoires sont impliqués. Les anticholinergiques tertiaires tels que l'atropine peut être utilisé comme un antidote pour ARICEPT surdosage. Intravenous sulfate d'atropine titré à effet est recommandé: une dose initiale de 1,0 à 2,0 mg IV avec des doses ultérieures en fonction de la réponse clinique. Les réponses atypiques de la pression artérielle et la fréquence cardiaque ont été rapportés avec d'autres cholinomimétiques en cas de co-administré avec des anticholinergiques quaternaires tels que le glycopyrrolate. On ne sait pas si ARICEPT et / ou ses métabolites peuvent être éliminés par dialyse (hémodialyse, la dialyse péritonéale ou hémofiltration).
signes liés à la dose de toxicité chez les animaux inclus mouvement réduite spontanée, position couchée, une démarche chancelante, larmoiement, convulsions cloniques, dépression respiratoire, salivation, myosis, tremblements, fasciculation et inférieure température de la surface du corps.
Dosage et administration
Les doses d’ARICEPT avérées efficaces dans des essais cliniques contrôlés sont 5 mg et 10 mg administré une fois par jour.
La plus forte dose de 10 mg n'a pas fourni un plus grand bénéfice clinique statistiquement significatif de 5 mg. Il y a une suggestion, cependant, basée sur ordre du groupe scores moyens et l'analyse des tendances de la dose des données de ces essais cliniques, une dose quotidienne de 10 mg d’ARICEPT pourrait fournir un avantage supplémentaire pour certains patients. En conséquence, si oui ou non d'employer une dose de 10 mg est une question de prescripteur et la préférence du patient.
Les données tirées des essais contrôlés indique que la dose de 10 mg, avec un titrage d'une semaine, est susceptible d'être associée à une incidence plus élevée d'événements indésirables cholinergiques que la dose de 5 mg. Dans les essais en ouvert à l'aide d'un titrage de 6 semaines, la fréquence de ces mêmes événements indésirables était similaire entre le 5 mg et 10 groupes de dose mg. Par conséquent, parce que l'état d'équilibre n'a pas été atteint pendant 15 jours et que l'incidence des effets indésirables peut être influencée par le taux d'augmentation de la dose, le traitement avec une dose de 10 mg ne doit pas être envisagé avant que les patients ont été sur une dose quotidienne de 5 mg pendant 4 à 6 semaines.
ARICEPT devrait être prise dans la soirée, juste avant de prendre sa retraite. ARICEPT peut être pris avec ou sans nourriture.
Laisser ARICEPT ODT comprimé à dissoudre sur la langue et suivre avec de l'eau.
Comment fournir?
ARICEPT est fourni sous forme de comprimés ronds pelliculés contenant 5 mg ou 10 mg de chlorhydrate de donépézil.
Les comprimés de 5 mg sont blancs. La force, en mg (5), est debossé sur un côté et ARICEPT est debossé de l'autre côté.
Les comprimés de 10 mg sont jaunes. La force, en mg (10), est débossé sur un côté et ARICEPT est debossé de l'autre côté.
5 mg (Blanc)
Bouteilles de 30 (NDC # 62856-245-30)
Bouteilles de 90 (NDC # 62856-245-90)
Unité Dose Blister Package 100 (10x10) (NDC # 62856-245-41)
10 mg (jaune) les
bouteilles de 30 (NDC # 62856-246-30)
Bouteilles de 90 (NDC # 62856-246-90)
Unité Dose Blister Package 100 (10x10) (NDC # 62856-246-41)
ARICEPT ODT est fourni sous forme de comprimés contenant soit 5mg ou 10mg de chlorhydrate de donépézil.
Les 5 mg comprimés à désintégration orale sont blancs. La force, en mg (5), est estampée sur un côté et qu'ARICEPT est gravé sur l'autre côté.
Les 10 mg par voie orale des comprimés à désintégration sont jaunes. La force, en mg (10) est estampée sur un côté et qu'ARICEPT est gravé sur l'autre côté.
5 mg (Blanc)
Unité Dose Blister Package 30 (10x3) (NDC # 62856-831-30)
10 mg (jaune)
Unité Dose Blister Package 30 (10x3) (NDC # 62856-832-30)
Stockage: Conserver à température ambiante contrôlée, 15 ° C à 30 ° C (59 ° F à 86 ° F).
RX seulement
ARICEPT est une marque déposée de
Eisai Co., Ltd.
fabriqué et commercialisé par Eisai Inc., Teaneck, NJ 07666
Commercialisé par Pfizer Inc., New York, NY 10017
ARICEPT (HCl donépézil) est une marque déposée d'Eisai Co., Ltd. Confidentialité / Mentions légales. Droit d'auteur (C) 2000 Eisai Inc. et Pfizer Inc. Tous droits réservés. ARICEPT (chlorhydrate de donépézil) est indiqué pour le traitement des symptômes de légère à modérée de la maladie d'Alzheimer.
ARICEPT (donepezil HCl) est bien toléré, mais peut-être pas pour tout le monde. Certaines personnes peuvent ressentir des nausées, la diarrhée, l'insomnie, des vomissements, des crampes musculaires, la fatigue ou la perte d'appétit. Dans les études, ces effets secondaires étaient généralement légers et temporaires. Certaines personnes prenant ARICEPT (donepezil HCl) peuvent éprouver des évanouissements. Les personnes à risque pour les ulcères doivent informer leurs médecins parce que leur état peut empirer.
Ce site peut contenir des informations relatives à diverses conditions médicales et leur traitement. Ces informations sont fournies uniquement à des fins éducatives et ne vise pas à se substituer à l'avis d'un médecin ou un autre professionnel de la santé. Vous ne devriez pas utiliser ces informations pour diagnostiquer un problème de santé ou de maladie. Afin de vous de prendre des décisions de soins de santé intelligents, vous devriez toujours consulter votre médecin ou un autre fournisseur de soins de santé pour vos besoins médicaux personnels.