Trintellix (vortioxétine) informations posologiques complètes
Nom de marque: Trintellix
Nom générique: vortioxétine
Trintellix est utilisé dans le traitement de la dépression majeure .
AVERTISSEMENT: PENSÉES ET COMPORTEMENTS SUICIDAL
Les antidépresseurs ont augmenté le risque de pensées et de comportements suicidaires chez les enfants, les adolescents et les jeunes adultes dans lesétudes à court terme. Ces études ne montrent pas une augmentation du risque de pensées et de comportements avec l’utilisation des antidépresseurs chez les patients de plus de 24 ans suicidaires; il y avait une tendance à la réduction du risque avec l’utilisation des antidépresseurs chez les patients âgés de 65 ans et plus.
Chez les patients de tous âges qui sont commencés sur un traitement antidépresseur, surveiller de près l’aggravation et à l’émergence de pensées et de comportements suicidaires. Conseiller les familles et les soignants de la nécessité d’une étroite observation et de communication avec le prescripteur
TRINTELLIX n'a pas été évaluée chez les patients pédiatriques
Indications et utilisation
Trouble dépressif majeur
TRINTELLIX est indiqué pour le traitement du trouble dépressif majeur (TDM).L'efficacité de TRINTELLIX a été créé en six 6 à 8 études de semaine (y compris une étude chez les personnes âgées) et une étude d'entretien chez les adultes
Dosage et administration
Instruction générale pour l'utilisation
La dose initiale recommandée est de 10 mg administrés par voie orale une fois par jour en dehors des repas. La posologie doit ensuite être augmentée à 20 mg / jour, selon la tolérance, parce que des doses plus élevées ont montré demeilleurs effets de traitement dans les essais menés aux États-Unis. L'efficacité et l’innocuité des doses supérieures à 20 mg / jour n'a pas été évaluée dans desessais cliniques contrôlés. Une diminution de la dose jusqu'à 5 mg / jour peut être envisagée chez les patients qui ne tolèrent pas des doses plus élevées
Traitement d'entretien / Continuation / Extended
Il est généralement admis que les épisodes aigus de dépression majeure devrait être suivie de plusieurs mois ou plus de pharmacothérapie soutenue. Une étude de l'entretien de TRINTELLIX a démontré que TRINTELLIX réduit le risque de récurrence des épisodes dépressifs comparé au placebo.
Traitement Abandon d'
Bien que TRINTELLIX peut être brusquement interrompu, dans les essais contrôlés par placebo les patients ont présenté des réactions indésirables transitoires tels que des maux de tête et la tension musculaire après l’arrêt brusque de TRINTELLIX 15 mg / jour ou 20 mg / jour. Pour éviter ces effets indésirables, il est recommandé que la dose soit réduite à 10 mg / jour pendant une semaine avant la pleine arrêt du TRINTELLIX 15 mg / jour ou 20 mg / jour
Changement d'un patient Pour ou De Monoamine Oxidase Inhibitor (IMAO) destiné à traiter les troubles psychiatriques
Au moins 14 jours doit être respecté entre l' arrêt d'un IMAO destinés à traiter les troubles psychiatriques et l' initiation du traitement avec TRINTELLIX pour éviter le risque de syndrome sérotoninergique. A l’inverse, au moins 21 jours doit être respecté après l’arrêt TRINTELLIX avant de commencer un traitement par IMAO destiné à traiter les troubles psychiatriques
Utilisation de TRINTELLIX avec les autres tels que les IMAO linézolide ou Bleu de Méthylène
Ne commencez pas TRINTELLIX chez un patient qui est traité avec linézolide ou intraveineuse de bleu de méthylène, car il y a un risque accru de syndrome sérotoninergique. Chez un patient qui a besoin d'un traitement plus urgent d'une affection psychiatrique, d’autres interventions, y compris l’hospitalisation, devrait être considérée
Dans certains cas, un patient recevant déjà un traitement de TRINTELLIX peut nécessiter un traitement d’urgence avec le linézolide ou intraveineuse de bleu de méthylène. Si des solutions de rechange acceptables pour le linézolide ou letraitement bleu de méthylène par voie intraveineuse ne sont pas disponibles et les avantages potentiels de linézolide ou intraveineuse un traitement bleu de méthylène sont jugés supérieurs aux risques de syndrome sérotoninergique chez un patient particulier, TRINTELLIX doit être arrêté rapidement, et le linézolide ou méthylène par voie intraveineuse bleu peut être administré. Le patient doit être contrôlé pour les symptômes du syndrome sérotoninergique pendant 21 jours ou jusqu'à 24 heures après la dernière dose de linézolide ou intraveineuse de bleu de méthylène, selon la première éventualité. La thérapie avec TRINTELLIX peut être reprise 24 heures après la dernière dose de linézolide ou intraveineuse de bleu de méthylène
Le risque d'administrer le bleu de méthylène par des voies non-intraveineux (telles que les comprimés oraux ou par injection locale) ou en doses intraveineuses bien inférieur à 1 mg / kg avec TRINTELLIX ne sait pas. Le clinicien doit, néanmoins, être conscient de la possibilité de symptômes émergents du syndrome sérotoninergique avec une telle utilisation
Utilisation de TRINTELLIX dans connus CYP2D6 pauvres Metabolizers ou chez les patients prenant des inhibiteurs du CYP2D6 forts
La dose maximale recommandée de TRINTELLIX est de 10 mg / jour chez les métaboliseurs lents du CYP2D6 connus. Réduire la dose de TRINTELLIX de moitié lorsque les patients reçoivent un inhibiteur puissant du CYP2D6 (par exemple, le bupropion, la fluoxétine, la paroxétine, ou quinidine) concomitantly.La dose doit être augmentée au niveau d’origine lorsque l'inhibiteur du CYP2D6 est arrêté.
Utilisation de TRINTELLIX chez les patients prenant inducteurs CYP forts
Envisagez d’augmenter la dose de TRINTELLIX quand un inducteur de CYP forte (par exemple, la rifampicine, la carbamazépine ou la phénytoïne) est coadministré pendant plus de 14 jours. La dose maximale recommandée ne doit pas dépasser trois fois la dose initiale. La dose de TRINTELLIX devrait être réduite au niveau d'origine dans les 14 jours, lorsque l'inducteur est arrêté
Formes et les forces de dosage
TRINTELLIX est disponible sous forme à libération immédiate, comprimés pelliculés dans les points forts suivants:
• 5 mg: rose, comprimé pelliculé d'amande biconvexe en forme, debossed avec "5" sur un côté et "TL" de l'autre côté
• 10 mg: jaune, comprimé pelliculé d'amande biconvexe en forme, debossed avec "10" sur un côté et "TL" de l'autre côté
• 15 mg: orange, comprimé pelliculé d'amande biconvexe en forme, debossed avec "15" sur un côté et "TL" de l'autre côté
• 20 mg: rouge, comprimé pelliculé d'amande biconvexe en forme, debossed avec "20" sur un côté et "TL" de l'autre côté
Contre-indications
• Hypersensibilité à vortioxétine ou tous les composants de la formulation.Œdème de Quincke a été rapporté chez des patients traités avec TRINTELLIX.
• L'utilisation des IMAO destiné à traiter les troubles psychiatriques avec TRINTELLIX ou dans les 21 jours suivant l'arrêt du traitement avec TRINTELLIX est contre -indiqué en raison d'un risque accru de syndrome sérotoninergique.L'utilisation de TRINTELLIX dans les 14 jours suivant l'arrêt d' un IMAO destiné à traiter les troubles psychiatriques est également contre -indiquée . A
partir TRINTELLIX chez un patient qui est traité avec des IMAO, comme lelinézolide ou intraveineuse de bleu de méthylène est également contre - raison d'une augmentation du risque de syndrome sérotoninergique
AVERTISSEMENTS ET PRECAUTIONS
Aggravation clinique et risque de suicide
Les patients présentant un trouble dépressif majeur (MDD), adulte et pédiatrique, peuvent connaître une aggravation de leur dépression et / ou l'émergence d'idées et de comportements suicidaires (suicidalité) ou des changements inhabituels dans le comportement, si oui ou non ils prennent des médicaments antidépresseurs, et cela le risque peut persister jusqu'à une rémission significative. Le suicide est un risque connu de la dépression et certains autres troubles psychiatriques, et ces troubles eux-mêmes sont les prédicteurs de suicide. Il a été une préoccupation de longue date, cependant, que les antidépresseurs peuvent avoir un rôle dans l'induction de l'aggravation de la dépression et l'émergence de la suicidalité chez certains patients au cours des premières phases du traitement. Les analyses mises en commun des études contrôlées par placebo à court terme de médicaments antidépresseurs (inhibiteurs de la recapture de la sérotonine [ISRS] et autres) ont montré que ces médicaments augmentent le risque de pensées suicidaires et de comportement (suicidalité) chez les enfants, les adolescents et les jeunes adultes (âgés de 18 ans à 24) et de TDM d'autres troubles psychiatriques. Des études à court terme n'a pas montré une augmentation du risque de suicidalité par antidépresseurs par rapport au placebo chez les adultes au-delà de 24 ans; il y avait une tendance à la réduction par antidépresseurs par rapport au placebo chez les adultes âgés de 65 ans et plus.
Les analyses groupées d'études contrôlées par placebo chez les enfants et les adolescents souffrant de TDM, le trouble obsessionnel compulsif (TOC), ou d'autres désordres psychiatriques ont inclus un total de 24 études à court terme de neuf médicaments antidépresseurs dans plus de 4.400 patients. Les analyses groupées d'études contrôlées par placebo chez les adultes souffrant de TDM ou d'autres désordres psychiatriques ont inclus un total de 295 études de courte durée (durée médiane de deux mois) de 11 médicaments antidépresseurs dans plus de 77.000 patients. Il y avait une variation considérable du risque de suicidalité parmi les médicaments, mais une tendance vers une augmentation des patients plus jeunes pour presque tous les médicaments étudiés. Il y avait des différences de risque absolu de suicidalité à travers les différentes indications, avec la plus forte incidence dans MDD. Les différences de risque (drogues par rapport au placebo), cependant, étaient relativement stables dans les strates d'âge et pour toutes les indications. Ces différences de risque (différence de placebo du médicament dans le nombre de cas de suicidalité pour 1000 patients traités) sont fournies dans le tableau 1.
Tableau 1. placebo du médicament Différence dans le nombre de
cas de Suicidality pour 1000 patients traités
|
|
Tranche d'âge
|
|
Augmente par rapport au placebo
|
|
<18
|
14 cas
supplémentaires
|
18-24
|
5 cas
supplémentaires
|
Diminue par rapport au placebo
|
|
25-64
|
1 moins de cas
|
≥65
|
6 moins de cas
|
Aucun suicide n’a eu lieu dans l'une des études pédiatriques. Il y avait des suicides dans les études adultes, mais le nombre n'a pas été suffisant pour parvenir à une conclusion à propos de l'effet du médicament sur le suicide.
On ignore si le risque de suicidalité étend à l'utilisation à long terme, à savoir, au-delà de plusieurs mois. Cependant, il existe des preuves substantielles d'études de maintenance contrôlées versus placebo chez les adultes souffrant de dépression que l'utilisation d'antidépresseurs peut retarder la récurrence de la dépression.
Tous les patients traités avec des antidépresseurs pour toute indication doivent être surveillés de manière appropriée et observés de près pour une aggravation clinique, suicidalité, et des changements inhabituels dans le comportement, en particulier pendant les mois initiaux d'un cours d'un traitement médicamenteux, ou lors des changements de dose, les augmentations ou diminue.
Les symptômes d'anxiété suivants, agitation, attaques de panique, l'insomnie, l'irritabilité, l'hostilité, l'agressivité, l'impulsivité, akathisie (agitation psychomotrice), hypomanie et manie ont été rapportés chez des patients adultes et pédiatriques traités avec des antidépresseurs pour MDD, ainsi que pour d'autres indications , tant psychiatriques que nonpsychiatriques. Bien qu'un lien causal entre l'apparition de ces symptômes et, soit l'aggravation de la dépression et / ou l'apparition d'impulsions suicidaires n'a pas été établie, il est à craindre que ces symptômes peuvent représenter des précurseurs de suicidalité émergents.
Il faudrait envisager de changer le schéma thérapeutique, y compris éventuellement l'arrêt du traitement, chez les patients dont la dépression est persistante pire, ou qui connaissent des tendances suicidaires ou des symptômes qui pourraient être des précurseurs de la dépression aggravation ou la suicidalité émergente, surtout si ces symptômes sont graves, abrupte dans le début, ou ne faisaient pas partie des symptômes de présentation du patient.
Les familles et les soignants des patients traités avec des antidépresseurs pour MDD ou d'autres indications, à la fois psychiatriques et non psychiatriques, doivent être avertis de la nécessité de surveiller les patients pour l'émergence de l'agitation, l'irritabilité, des changements inhabituels dans le comportement, et les autres symptômes décrits ci-dessus, ainsi que l'émergence de la suicidalité, et de signaler immédiatement ces symptômes à des fournisseurs de soins de santé.Cette surveillance devrait inclure l'observation quotidienne par les familles et les aidants naturels.
Le dépistage des patients pour le trouble bipolaire
Un épisode dépressif majeur peut être la présentation initiale d'un trouble bipolaire. On croit généralement (mais pas établie dans des études contrôlées) que le traitement d'un tel épisode avec un antidépresseur seul peut augmenter la probabilité de précipitations d'un épisode mixte / maniaque chez les patients à risque de trouble bipolaire. Que ce soit l'un des symptômes décrits ci-dessus représentent
Une telle conversion est inconnue. Cependant, avant de commencer le traitement avec un antidépresseur, les patients présentant des symptômes dépressifs devraient être suffisamment pour déterminer si elles sont à risque de trouble bipolaire; ce dépistage devrait inclure une histoire psychiatrique détaillée, y compris une histoire de famille de suicide, les troubles bipolaires et la dépression.Il convient de noter que TRINTELLIX n’est pas approuvé pour une utilisation dans le traitement de la dépression bipolaire.
Syndrome sérotoninergique
Le développement d'un syndrome sérotoninergique potentiellement mortelle a été rapporté avec des antidépresseurs sérotoninergiques y compris TRINTELLIX, lorsqu'ils sont utilisés seuls, mais plus souvent en cas d'utilisation concomitante avec d'autres médicaments sérotoninergiques (y compris les triptans, les antidépresseurs tricycliques, le fentanyl, le lithium, le tramadol, le tryptophane, la buspirone, et millepertuis), et avec des médicaments qui diminuent le métabolisme de la sérotonine (en particulier, les IMAO, à la fois ceux qui sont destinés à traiter les troubles psychiatriques et aussi d'autres, comme le linézolide et intraveineuse de bleu de méthylène).
Les symptômes du syndrome sérotoninergique peuvent inclure des changements de l'état mental (par exemple, agitation, hallucinations, délire et coma), instabilité autonome (par exemple, tachycardie, variation de la pression artérielle, des étourdissements, diaphorèse, bouffées de chaleur, hyperthermie), des symptômes neuromusculaires (par exemple, le tremblement, la rigidité, myoclonies, hyperréflexie, incoordination), des convulsions, et ou des symptômes gastro-intestinaux / (par exemple, nausées, vomissements, diarrhée). Les patients doivent être surveillés pour l'émergence d'un syndrome sérotoninergique.
L'utilisation concomitante de TRINTELLIX avec IMAO destiné à traiter les troubles psychiatriques est contre -indiquée. TRINTELLIX ne devrait pas être démarré chez un patient qui est traité avec des IMAO tels que le linézolide ou intraveineuse debleu de méthylène. Tous les rapports avec le bleu de méthylène qui a fourni desinformations sur la voie d'administration impliqués administration intraveineuse dans la gamme de dose de 1 mg / kg à 8 mg / kg. Aucun rapport n'a été associés àl'administration de bleu de méthylène par d’autres voies ( par exemple sous forme de comprimés par voie orale ou injection dans un tissu local) ou à des doses plus faibles. Il peut y avoir des circonstances où il est nécessaire d'initier le traitement avec un IMAO comme le linézolide ou intraveineuse de bleu de méthylène chez un patient prenant TRINTELLIX. TRINTELLIX doit être interrompu avant d' initier le traitement avec l'IMAO
Si l'utilisation concomitante de TRINTELLIX avec d'autres médicaments sérotoninergiques, y compris les triptans, les antidépresseurs tricycliques, le fentanyl, le lithium, le tramadol, la buspirone, le tryptophane, et le millepertuis est cliniquement justifié, les patients doivent être informés d'un risque accru de syndrome sérotoninergique, en particulier lors de l'initiation du traitement et la dose augmente.
Le traitement avec TRINTELLIX et tous les agents sérotoninergiques concomitants doit être arrêté immédiatement si les événements ci-dessus se produisent et un traitement symptomatique approprié doit être instauré.
Saignement anormal
L'utilisation de médicaments qui interfèrent avec l'inhibition de la recapture de la sérotonine, y compris TRINTELLIX, peut augmenter le risque d'événements saignants. L'utilisation concomitante de l'aspirine, les médicaments anti-inflammatoires non stéroïdiens (AINS), la warfarine, et d'autres anticoagulants peuvent ajouter à ce risque. Les rapports de cas et d'études épidémiologiques (cas-témoins et de conception de cohorte) ont démontré une association entre l'utilisation de médicaments qui interfèrent avec la recapture de la sérotonine et la survenue de saignements gastro-intestinaux. Saignement des événements liés à des médicaments qui inhibent la recapture de la sérotonine ont varié d'ecchymose, hématome, épistaxis et pétéchies aux hémorragies mortelles.
Les patients doivent être mis en garde sur le risque accru de saignement quand TRINTELLIX est coadministré avec les AINS, l’aspirine ou d' autres médicaments qui affectent la coagulation ou de saignement
Activation de manie / hypomanie
Les symptômes de manie / hypomanie ont été rapportés chez <0,1% des patients traités par TRINTELLIX en pré-commercialisation des études cliniques.L'activation de manie / hypomanie a été rapporté dans une petite proportion de patients souffrant de troubles affectifs majeurs qui ont été traités avec d'autres antidépresseurs. Comme avec tous les antidépresseurs, utilisez TRINTELLIX avec prudence chez les patients ayant des antécédents de trouble bipolaire, la manie ou d'hypomanie l'histoire ou de la famille.
Hyponatrémie
L’hyponatrémie est survenue à la suite d' un traitement avec des médicaments sérotoninergiques. Dans de nombreux cas, hyponatrémie semble être le résultat du syndrome de sécrétion inappropriée d'hormone anti- diurétique (SIADH). Un cas avec du sodium sérique inférieur à 110 mmol / L a été signalé chez un sujet traité avec TRINTELLIX dans une étude clinique de pré-commercialisation. Les patients âgés peuvent être plus à risque de développer une hyponatrémie avec un antidépresseur sérotoninergique. En outre, les patients prenant desdiurétiques ou qui sont autrement hypovolémie peuvent être plus à risque.Cessation de TRINTELLIX chez les patients présentant une hyponatrémie symptomatique et médical approprié
intervention devrait être institué. Les signes et symptômes de l’hyponatrémie comprennent des maux de tête, difficulté à se concentrer, troubles de la mémoire, de la confusion, la faiblesse et l’instabilité, ce qui peut conduire à des chutes. Les cas plus graves et / ou aigus ont inclus l’hallucination, la syncope, la saisie, lecoma, arrêt respiratoire, et la mort.
Effets indésirables
Les effets indésirables suivants sont discutés plus en détail dans d'autres sections de l'étiquette.
• Hypersensibilité
• Aggravation clinique et risque de suicide
• syndrome sérotoninergique
• saignement anormal
• Activation de manie / hypomanie
• hyponatrémie
Etudes cliniques Expérience
Puisque les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux dans les études cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
L'exposition des patients
TRINTELLIX a été évalué pour la sécurité dans les 4746 patients (18 ans à 88 ans) diagnostiquées avec MDD qui ont participé à des études cliniques pré-commercialisation; 2616 de ces patients ont été exposés à TRINTELLIX chez 6 à 8 semaines, des études contrôlées par placebo à des doses allant de
5 mg à 20 mg une fois par jour et 204 patients ont été exposés à TRINTELLIX dans une étude de maintien contrôlé par placebo à 24 semaines 64 semaines à des doses de 5 mg à 10 mg une fois par jour. Les patients des 6 à 8 études de semaine ont continué dans 12 mois études ouvertes. Un total de 2586 patients ont été exposés à au moins une dose de TRINTELLIX en études ouvertes 1727 ont été exposés à TRINTELLIX pendant six mois et 885 ont été exposés pendant au moins un an.
Effets indésirables signalés comme Raisons de l'arrêt du traitement
Dans les études contrôlées par placebo 6 à 8 semaines groupées l'incidence des patients qui ont reçu TRINTELLIX 5 mg / jour, 10 mg / jour, 15 mg / jour et 20 mg / jour et ont interrompu le traitement en raison d'une réaction indésirable était de 5%, 6% , 8% et 8%, respectivement, par rapport à 4% des patients traités par placebo. Nausées a été la réaction indésirable le plus fréquemment signalé comme motif d'arrêt.
Réactions indésirables fréquents dans les études contrôlées par placebo CDEM
Les effets indésirables les plus fréquemment observés chez les patients traités avec CDEM TRINTELLIX dans des études contrôlées par placebo 6 à 8 semaines (incidence ≥5% et au moins deux fois le taux de placebo) étaient la nausée, la constipation et des vomissements.
Le tableau 2 montre l'incidence des effets indésirables fréquents qui se sont produits dans ≥2% des patients traités avec CDEM toute dose de TRINTELLIX et au moins 2% plus fréquemment que chez les patients traités par placebo dans les études contrôlées par placebo 6 à 8 semaines.
La nausée
Nausées était réaction indésirable la plus courante et sa fréquence a été liée à la dose (tableau 2). Il a été généralement considéré comme légère ou modérée en intensité et la durée médiane était de 2 semaines. Nausées était plus fréquente chez les femmes que chez les hommes. Nausées le plus souvent eu lieu dans la première semaine de traitement TRINTELLIX avec 15 à 20% des patients souffrant de nausées après 1 à 2 jours de traitement. Environ 10% des patients prenant TRINTELLIX 10 mg / jour à 20 mg / jour a eu des nausées, à la fin des études contrôlées par placebo 6 à 8 semaines.
Dysfonction sexuelle
Difficultés dans le désir sexuel, la performance sexuelle et la satisfaction sexuelle se produisent souvent comme des manifestations de troubles psychiatriques, mais ils peuvent aussi avoir des conséquences d'un traitement pharmacologique.
Dans les CDEM 6 à 8 semaines d'essais contrôlés de TRINTELLIX, volontairement signalé des effets indésirables liés à la dysfonction sexuelle ont été capturés en termes d'événements individuels. Ces termes d'événements ont été agrégés et l'incidence globale était la suivante. Chez l'homme, l'incidence globale était de 3%, 4%, 4%, 5% en TRINTELLIX 5 mg / jour, 10 mg / jour, 15 mg / jour, 20 mg / jour, respectivement, par rapport à 2% dans le groupe placebo. Chez les femmes, l'incidence globale était <1%, 1%, <1%, 2% en TRINTELLIX 5 mg / jour, 10 mg / jour, 15 mg / jour, 20 mg / jour, respectivement, par rapport à <1% dans le groupe placebo.
Parce que les réactions sexuelles indésirables volontairement rapportés sont connus pour être sous-estimée, en partie parce que les patients et les médecins peuvent être réticents à en discuter, l'Arizona Sexual Experiences Scale (ASEX), une mesure validée conçu pour identifier les effets secondaires sexuels, a été utilisé de manière prospective dans sept placebos essais. Contrôlées par L'échelle de ASEX comprend cinq questions qui se rapportent aux aspects suivants de la fonction sexuelle: 1) de la libido, 2) la facilité d'excitation, 3) la capacité à obtenir une érection (hommes) ou lubrification (femmes), 4) la facilité d'atteindre l'orgasme, et 5) la satisfaction de l'orgasme.
La présence ou l'absence de dysfonction sexuelle chez les patients qui entrent dans les études cliniques était basée sur leurs scores de ASEX. Pour les patients sans dysfonctionnement sexuel au départ (environ 1/3 de la population dans tous les groupes de traitement dans chaque étude), le tableau 3 montre l'incidence des patients qui ont développé une dysfonction sexuelle liée au traitement lorsqu'ils sont traités avec TRINTELLIX ou un placebo dans un groupe à dose fixe. Les médecins devraient se renseigner régulièrement sur les éventuels effets secondaires sexuels.
Tableau 3. ASEX Incidence du traitement Emergent Dysfonction
sexuelle *
|
|||||
TRINTELLIX
5 mg / jour N = 65: 67 † |
TRINTELLIX
10 mg / jour N = 94: 86 † |
TRINTELLIX
15 mg / jour N = 57: 67 † |
TRINTELLIX
20 mg / jour N = 67: 59 † |
Placebo
N = 135: 162 † |
|
Femmes
|
22%
|
23%
|
33%
|
de 34%
|
20%
|
Mâles
|
16%
|
20%
|
19%
|
29%
|
14%
|
* Incidence
basée sur le nombre de sujets
atteints de dysfonction
sexuelle pendant l'étude / nombre de sujets sans dysfonctionnement sexuel au
départ. La dysfonction sexuelle
a été définie comme un sujet marquant une des opérations suivantes sur
l'échelle ASEX à deux visites successives au cours de l'étude: 1) lescore total ≥19; 2) tout seul article ≥5; 3) trois ou plusieurs éléments
chacun avec un score ≥4
† Taille de l’échantillon pour chaque groupe de dose est le nombre de patients (femmes: hommes) sans dysfonction sexuelle au départ |
|||||
† Taille de l’échantillon pour chaque groupe de dose est le nombre de patients (femmes: hommes) sans dysfonction sexuelle au départ
Effets indésirables suivants Abrupt Cessation de Traitement TRINTELLIX
Des symptômes de sevrage ont été évalué de façon prospective chez les patients prenant TRINTELLIX 10 mg / jour, 15 mg / jour et 20 mg / jour en utilisant la Cessation-Emergent Signes et symptômes (DESS) échelle dans les essais cliniques. Certains patients ont présenté des symptômes de sevrage tels que maux de tête, tension musculaire, des sautes d'humeur, des explosions soudaines de colère, des étourdissements, et le nez qui coule dans la première semaine de l'arrêt brutal du TRINTELLIX 15 mg / jour et 20 mg / jour.
Tests de laboratoire
TRINTELLIX n'a pas été associée à des changements cliniquement importants dans les paramètres des tests de laboratoire en chimie sérique (sauf sodium), l'hématologie et l'analyse d'urine, telle que mesurée dans
les études contrôlées par placebo 6 à 8 semaines. L' hyponatrémie a été rapportée avec le traitement de TRINTELLIX..Dans le 6 mois, en double aveugle, de phase contrôlée par placebo d'une étude à long terme chez les patients qui avaient répondu à TRINTELLIX au cours des 12 semaines, phase initiale ouverte, il n'y avait aucun changement cliniquement importants dans les paramètres des tests de laboratoire entre TRINTELLIX et les patients traités par placebo.
Poids
TRINTELLIX n'a eu aucun effet significatif sur le poids du corps, telle que mesurée par la variation moyenne par rapport au départ dans les études contrôlées par placebo 6 à 8 semaines. Dans le 6 mois, en double aveugle, contre placebo de phase contrôlée d'une étude à long terme chez les patients qui avaient répondu à TRINTELLIX au cours des 12 semaines, phase initiale ouverte, il n'y avait pas d'effet significatif sur le poids corporel entre TRINTELLIX et patients traités par placebo.
Signes vitaux
TRINTELLIX n'a pas été associée à des effets cliniquement significatifs sur les signes vitaux, y compris systolique et diastolique pression artérielle et la fréquence cardiaque, telle que mesurée dans les études contrôlées versus placebo.
Autres effets indésirables observés dans les études cliniques
La liste suivante ne comprend pas les réactions: 1) déjà mentionnés dans les tableaux précédents ou ailleurs dans l'étiquetage, 2) pour lesquels une cause de médicament était à distance, 3), qui étaient si généraux pour être non, 4) qui ne sont pas considérés comme ayant significatif implications cliniques, ou 5) qui se sont produits à un taux inférieur ou égal à un placebo.
• Oreille et du labyrinthe - vertiges
• Affections gastro-intestinales - dyspepsie
• Affections du système nerveux - dysgueusie
• Troubles vasculaires - rinçage
Interactions médicamenteuses
SNC Agents actifs
Inhibiteurs de la monoamine oxydase
Les effets indésirables, dont certaines sont graves , voire mortelles, peuvent se développer chez les patients qui utilisent IMAO ou qui ont récemment été abandonnées à partir d' un IMAO et ouvertes sur un antidépresseur (s) sérotoninergique ou qui ont eu récemment ISRS ou SNRI traitement interrompu avant le début du un IMAO
Médicaments sérotoninergiques
Basé sur le mécanisme d'action de TRINTELLIX et le potentiel de toxicité de la sérotonine, un syndrome sérotoninergique peut se produire lorsque TRINTELLIX est administré avec d’autres médicaments qui peuvent affecter les sérotoninergiques systèmes de neurotransmetteurs (par exemple, ISRS, IRSN, triptans, buspirone, le tramadol et produits tryptophane, etc. .). Surveiller étroitement les symptômes du syndrome sérotoninergique si TRINTELLIX est co-administré avec d' autres médicaments sérotoninergiques. Le traitement avec TRINTELLIX et tous les agents sérotoninergiques concomitants doit être arrêté immédiatement si le syndrome sérotoninergique se produit
Autres agents actifs du SNC
Aucun effet cliniquement significatif n'a été observé sur l'exposition au lithium état d'équilibre après l'administration concomitante de doses quotidiennes multiples de TRINTELLIX. Des doses multiples de TRINTELLIX n'a pas affecté les propriétés pharmacocinétiques ou pharmacodynamiques (score cognitif composite) de diazépam. Une étude clinique a montré que TRINTELLIX (dose unique de 20 ou 40 mg) n'a pas augmenté la dépréciation des facultés mentales et motrices causées par l'alcool (dose unique de 0,6 g / kg). Les détails sur les interactions pharmacocinétiques potentielles entre TRINTELLIX et bupropion peuvent être trouvés dans la section 7.3.
Les médicaments qui interfèrent avec l'hémostase (par exemple, les AINS, aspirine et warfarine)
La libération de Serotonin par les plaquettes joue un rôle important dans l'hémostase. Les études épidémiologiques de cas-témoins et la conception de cohorte ont démontré une association entre l'utilisation de médicaments psychotropes qui interfèrent avec la recapture de la sérotonine et la survenue d'un saignement gastro-intestinal supérieur. Ces études ont également montré que l'utilisation concomitante d'un AINS ou d'aspirine peut potentialiser le risque de saignement. effets anticoagulants Altered, y compris une augmentation des saignements, ont été rapportés lorsque les ISRS et IRSN sont coadministered avec la warfarine.
Suite à l'administration concomitante de doses stables de la warfarine (1 à 10 mg / jour) avec de multiples doses quotidiennes de TRINTELLIX, aucun effet significatif n'a été observé dans la pharmacocinétique INR, les valeurs de prothrombine ou la warfarine totale (protéine liée, plus sans drogue) pour les deux R- et S- warfarine [voir Interactions médicamenteuses (7.4)]. L'administration concomitante d'aspirine 150 mg / jour avec des doses quotidiennes multiples de TRINTELLIX n'a eu aucun effet inhibiteur significatif sur l'agrégation plaquettaire ou la pharmacocinétique de l'aspirine et l'acide salicylique [(voir Interactions médicamenteuses (7.4)]. Les patients recevant d'autres médicaments qui interfèrent avec l'hémostase doit être étroitement surveillée lorsque TRINTELLIX est lancé ou arrêté
Effets potentiels d'autres médicaments sur TRINTELLIX
Réduire la dose de TRINTELLIX de moitié par un inhibiteur de la CYP2D6 forte (par exemple, le bupropion, la fluoxétine, la paroxétine, quinidine) est coadministré. Envisagez d'augmenter la dose de TRINTELLIX quand un inducteur de CYP forte (par exemple, la rifampicine, la carbamazépine, la phénytoïne) est coadministré. La dose maximale est recommandée de ne pas dépasser trois fois la dose initiale [voir le Dosage et l'administration (2.5 et 2.6)] (figure 1).
Figure 1. Impact des autres médicaments sur vortioxétine PK
Potentiel de TRINTELLIX sur d'autres médicaments
Aucun ajustement de la dose pour les co- administrés est nécessaire lorsque TRINTELLIX est coadministré avec un substrat du CYP1A2 (par exemple, la duloxétine), CYP2A6, CYP2B6 (par exemple, le bupropion), CYP2C8 (par exemple, répaglinide), CYP2C9 (par exemple, S-warfarine), CYP2C19 (par exemple, le diazépam), CYP2D6 (par exemple, venlafaxine), CYP3A4 / 5 (par exemple, le budésonide), et P-gp (par exemple, la digoxine). En outre, aucun ajustement de la dose pour le lithium, l'aspirine et la warfarine n’est nécessaire.
Vortioxétine et ses métabolites sont peu susceptibles d'inhiber les enzymes CYP suivantes et transporteur à partir de données in vitro: CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4 / 5 et P-gp. En tant que tel, aucune interaction cliniquement pertinente avec les médicaments métabolisés par ces enzymes CYP seraient attendus.
En outre, vortioxétine n'a pas induit de CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 et CYP3A4 / 5 dans une étude in vitro dans des hépatocytes humains en culture. L'administration chronique de TRINTELLIX est peu susceptible d'induire le métabolisme des médicaments métabolisés par ces isoformes de CYP. En outre, dans une série d'études sur les interactions médicamenteuses cliniques, l'administration concomitante de TRINTELLIX avec des substrats pour CYP2B6 (par exemple, bupropion), CYP2C9 (par exemple, warfarine), et CYP2C19 (par exemple, le diazépam), n'a eu aucun effet significatif clinique sur la pharmacocinétique de ces substrats (Figure 2).
Parce que vortioxétine est fortement lié aux protéines plasmatiques, lacoadministration de TRINTELLIX avec un autre médicament qui est fortement lié aux protéines peut augmenter les concentrations libres de l'autre médicament.Cependant, dans une étude clinique avec coadministration de TRINTELLIX (10 mg / jour) et de warfarine (1 mg / jour à 10 mg / jour), un médicament très lié à uneprotéine, aucun changement significatif dans INR a été observée
Figure 2. Impact de vortioxétine sur PK d'autres drogues
Utilisation Dans les Populations Spécifiques
Grossesse
Catégorie de grossesse c
Résumé des risques
Il n'y a pas d'études adéquates et bien contrôlées de TRINTELLIX chez les femmes enceintes. Vortioxétine a causé des retards de développement lorsqu'il est administré pendant la grossesse chez le rat et le lapin à des doses de 15 et 10 fois la dose maximale recommandée chez l'homme (MRHD) de 20 mg, respectivement. Les retards de développement ont également été observés après la naissance chez les rats à des doses 20 fois le MRHD de vortioxétine donnée pendant la grossesse et pendant l'allaitement. Il n'y avait pas d'effets tératogènes chez le rat ou le lapin à des doses allant jusqu'à 77 et 58 fois, le MRHD de vortioxétine, respectivement, étant donné pendant l'organogenèse. L'incidence des malformations dans la grossesse humaine n'a pas été établie pour TRINTELLIX. Toutes les grossesses humaines, quel que soit l'exposition au médicament, ont un taux de base de 2 à 4% pour les malformations majeures, et 15 à 20% pour la perte de la grossesse. TRINTELLIX doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Considérations cliniques
Neonates exposés aux ISRS ou IRSN, la fin du troisième trimestre ont développé des complications nécessitant une hospitalisation prolongée, le soutien respiratoire et l’alimentation par sonde. Ces complications peuvent survenir immédiatement après l’accouchement. Les cas cliniques signalés ont inclus ladétresse respiratoire, cyanose, apnée, convulsions, instabilité de la température, de la difficulté d’alimentation, vomissements, hypoglycémie, hypotonie, hypertonie, tremblements, nervosité, irritabilité et pleurs constants. Ces caractéristiques sont compatibles avec un effet toxique direct de ces classes de médicaments ou peut - être, un syndrome d'arrêt du médicament. Il convient de noter que dans certains cas, le tableau clinique est compatible avec un syndrome sérotoninergique .Lorsque le traitement d'une femme enceinte avec TRINTELLIX au cours du troisième trimestre, le médecin devrait examiner attentivement les risques potentiels et les avantages du traitement.
Les nouveau-nés exposés aux ISRS pendant la grossesse peuvent avoir un risque accru d'hypertension pulmonaire persistante du nouveau-né (PPHN).PPHN se produit dans un à deux pour 1000 naissances vivantes dans la population générale et est associée à une morbidité néonatale importante et de mortalité. Plusieurs études épidémiologiques récentes suggèrent une association statistique positive entre l'utilisation des ISRS pendant la grossesse et PPHN.D'autres études ne montrent pas une association statistique significative.
Une étude longitudinale prospective a été menée sur 201 femmes enceintes ayant des antécédents de dépression majeure, qui étaient soit des antidépresseurs ou avaient reçu des antidépresseurs moins de
12 semaines avant leur dernière période menstruelle, et étaient en rémission. Les femmes qui ont arrêté des antidépresseurs pendant la grossesse ont montré une augmentation significative de la rechute de leur dépression majeure par rapport à ces femmes qui sont restées sur le médicament antidépresseur pendant lagrossesse. Lorsque le traitement d’une femme enceinte avec TRINTELLIX, le médecin doit examiner attentivement les risques potentiels de prendre un antidépresseur sérotoninergique, ainsi que les avantages établis de traitement de la dépression avec un antidépresseur.
Données animales
Chez les rats enceintes et les lapins, aucun effet tératogène n'a été observé lorsque vortioxétine a été donné au cours de la période de l'organogenèse à des doses orales allant jusqu'à 160 et 60 mg / kg / jour, respectivement. Ces doses sont 77 et 58 fois, chez les rats et les lapins, respectivement, la dose humaine recommandée maximum (MRHD) de 20 mg sur une base mg / m2. Le retard de développement, considérée comme une diminution du poids corporel fœtal et retard de l'ossification, a eu lieu chez le rat et le lapin à des doses égales et supérieures à 30 et 10 mg / kg (15 et 10 fois le MRHD, respectivement) en présence de toxicité maternelle (diminution de la nourriture la consommation et une diminution du gain de poids corporel). Lorsque vortioxétine a été administré à des rates gravides à des doses orales allant jusqu'à 120 mg / kg (58 fois le MRHD) pendant toute la grossesse et l'allaitement, le nombre de petits nés vivants a été diminué et la mortalité des petits postnatale précoce a été augmenté à 40 et 120 mg / kg . En outre, du poids des petits ont été réduits à la naissance au sevrage à 120 mg / kg et le développement (ouverture spécifiquement des yeux) a été légèrement retardé à 40 et 120 mg / kg. Ces effets ne sont pas observés à 10 mg / kg (5 fois le MRHD).
Mères infirmières
On ne sait pas si vortioxétine est présent dans le lait humain. Vortioxétine est présent dans le lait des rates allaitantes. Puisque beaucoup de médicaments sont présents dans le lait maternel et en raison du risque de réactions indésirables graves chez les nourrissons de TRINTELLIX, une décision devrait être prise soit d'interrompre l'allaitement ou arrêter le médicament, en tenant compte de l'importance du médicament pour la mère.
Utilisation de pédiatrie
Des études cliniques sur l'utilisation de TRINTELLIX chez les patients pédiatriques n'a été menée; par conséquent, la sécurité et l'efficacité des TRINTELLIX dans la population pédiatrique n'a pas été établie.
utilisation gériatrique
Aucun ajustement de la dose n’est recommandé sur la base de l'âge (figure 3). Les résultats d'une étude pharmacocinétique à dose unique chez les personnes âgées (> 65 ans) par rapport aux jeunes (âgés de 24 à 45 ans) sujets ont démontré que la pharmacocinétique étaient généralement similaires entre les deux groupes d'âge.
Sur les 2616 sujets dans les études cliniques de TRINTELLIX, 11% (286) étaient 65 ans et plus, qui comprenait des sujets d'une étude contrôlée par placebo spécifiquement chez les patients âgés. Aucune différence totale dans la sécurité ou l’efficacité n'a été observée entre ces sujets et les sujets plus jeunes et d' autre expérience clinique annoncée n'a pas identifié dedifférences en réponses entre les patients âgés et plus jeunes.
Les antidépresseurs sérotoninergiques ont été associés à des cas d'hyponatrémie cliniquement significative chez les patients âgés, qui peuvent être plus à risque pour cet événement défavorable
Utiliser dans d'autres populations de patients
Aucun ajustement de la dose de TRINTELLIX sur la base de la race, le sexe, l'origine ethnique, ou de la fonction rénale (d'une insuffisance rénale légère à fin stade de la maladie rénale) est nécessaire. En outre, la même dose peut être administrée chez les patients avec insuffisance hépatique légère à modérée (Figure 3). TRINTELLIX n'a pas été étudié chez les patients présentant une insuffisance hépatique sévère. Par conséquent, TRINTELLIX est déconseillée chez les patients présentant une insuffisance hépatique sévère.
Figure 3. Impact des facteurs intrinsèques sur vortioxétine PK
Abus de drogues et de dépendance
Substance contrôlée
TRINTELLIX n’est pas une substance contrôlée.
Surdosage
Expérience humaine
L'expérience clinique est limitée sur le surdosage humain avec TRINTELLIX .Dans les études cliniques pré-commercialisation, des cas de surdosage ont été limitées à des patients qui accidentellement ou intentionnellement consommé jusqu'à une dose maximale de 40 mg de TRINTELLIX. La dose unique maximale testée était de 75 mg chez les hommes. L'ingestion de TRINTELLIX dans l'intervalle de dose de 40 à 75 mg a été associée à une augmentation des taux de nausées, des étourdissements, de la diarrhée, des douleurs abdominales, prurit généralisé, somnolence, et le rinçage.
Direction de Surdosage
Aucun antidote spécifique pour TRINTELLIX sont connus. Dans la gestion de surdosage, envisager la possibilité de participation de médicament multiple. En cas de surdosage, appelez le Centre antipoison pour les dernières recommandations.
La description
TRINTELLIX est un comprimé à libération immédiate pour l'administration orale qui contient le polymorphe bêta (β) de vortioxétine bromhydrate (HBr), un antidépresseur. Vortioxétine HBr est connu chimiquement comme le 1- [2- (2,4-diméthyl-phénylsulfanyl) -phényl] -pipérazine, le bromhydrate. La formule empirique C18 H22 N2 S, HBr avec un poids moléculaire de 379,36 g / mol. La formule développée est la suivante:
Vortioxétine HBr est une poudre blanche à très légèrement beige qui est légèrement soluble dans l'eau.
Chaque comprimé contient 6,355 mg TRINTELLIX, 12,71 mg 19,065 mg, soit 25,42 mg de HBr vortioxétine équivalent à 5 mg, 10 mg, 15 mg ou 20 mg de vortioxétine, respectivement. Les ingrédients inactifs dans les comprimés TRINTELLIX comprennent le mannitol, la cellulose microcristalline, l'hydroxypropylcellulose, l'amidon glycolate de sodium, le stéarate de magnésium et le revêtement de film qui consiste en l'hypromellose, du dioxyde de titane, polyéthylèneglycol 400, oxyde de fer rouge (5 mg, 15 mg et 20 mg) et le jaune d'oxyde de fer (10 mg et 15 mg).
Pharmacologie clinique
Mécanisme d'action
Le mécanisme de l'effet antidépresseur de vortioxétine n'a pas été complètement élucidé, mais on pense être lié à l'amélioration de l'activité sérotonergique dans le système nerveux central par l'inhibition de la recapture de la sérotonine (5-HT). Il a également plusieurs autres activités, y compris 5-HT3 antagoniste des récepteurs 5-HT1A et récepteur agonisme. La contribution de ces activités à l'effet antidépresseur de vortioxétine n'a pas été établie.
Pharmacodynamique
Vortioxétine se lie avec une affinité élevée pour le transporteur de serotonine humain (Ki = 1,6 nM), mais pas à la norepinephrine (Ki = 113 nM) ou de la dopamine (Ki> 1000 nM) transporteurs. Vortioxétine puissant et sélectif inhibe recapture de la sérotonine (CI50 = 5,4 nM). Vortioxétine se lie à 5-HT3 (Ki = 3,7 nM), 5-HT1A (Ki = 15 nM), 5-HT7 (Ki = 19 nM), 5-HT1D (Ki = 54 nM) et 5-HT1B (Ki = 33 nM), des récepteurs et est un 5-HT3, 5-HT1D et 5-HT7 antagoniste des récepteurs 5-HT1B agoniste partiel des récepteurs, et 5-HT1A agoniste du récepteur.
Chez les humains, la moyenne de 5-HT transporteur occupation, sur la base des résultats de 2 études TEP cliniques utilisant des ligands 5-HTT ([11C] -MADAM ou [11C] -DASB), était d'environ 50% à 5 mg / jour, 65 % à 10 mg / jour et environ 80% à 20 mg / jour dans les régions d'intérêt.
Effet sur la repolarisation cardiaque
L'effet de vortioxétine 10 mg et 40 mg administré une fois par jour sur l'intervalle QTc a été évalué dans une, randomisée en double aveugle, contre placebo et témoin actif (moxifloxacine 400 mg), étude parallèle à quatre traitements bras dans 340 sujets de sexe masculin. Dans l'étude, la limite supérieure de l'un intervalle de confiance unilatéral de 95% pour l'QTc était inférieure à 10 ms, le seuil de préoccupation réglementaire. La dose orale de 40 mg est suffisante pour évaluer l'effet de l'inhibition métabolique.
Effet sur la performance de conduite
Dans une étude clinique chez des sujets sains, TRINTELLIX n'a pas nuire à la performance de conduite, ou ont psychomoteur défavorable ou effets cognitifs après des doses uniques et multiples de 10 mg / jour. Parce que tout médicament psychotrope peut altérer le jugement, la capacité de raisonnement, ou moteur, cependant, les patients doivent être avertis machines dangereuses d'exploitation, y compris les automobiles, jusqu'à ce qu'ils soient raisonnablement sûrs que la thérapie TRINTELLIX n'a aucune incidence sur leur capacité de se livrer à de telles activités.
Pharmacokinetics
Vortioxétine activité pharmacologique est due à la molécule mère. La pharmacocinétique de la vortioxétine (2,5 mg à 60 mg) sont linéaires et proportionnelle à la dose quand vortioxétine est administré une fois par jour. La demi-vie terminale moyenne est d'environ 66 heures, les concentrations plasmatiques de l'état d'équilibre sont généralement obtenues dans les deux semaines de traitement.
Absorption
La concentration de vortioxétine plasmatique maximale (Cmax) après le dosage est atteinte dans les 7 à 11 heures après l'administration (Tmax). l'état d'équilibre des valeurs moyennes de Cmax étaient de 9, 18 et 33 ng / ml après administration de doses de 5, 10 et 20 mg / jour. La biodisponibilité absolue est de 75%. Aucun effet de la nourriture sur la pharmacocinétique n'a été observé.
Distribution
Le volume apparent de distribution de vortioxétine est d'environ 2600 L, indiquant une distribution extravasculaire. La liaison de l'vortioxétine chez l'être humain aux protéines plasmatiques est de 98%, indépendamment de la concentration plasmatique. Aucune différence apparente dans la liaison entre les sujets et les sujets sains présentant une insuffisance hépatique (légère, modérée) ou rénale (légère, modérée, sévère, STIR) déficience est observée aux protéines plasmatiques.
Métabolisme et élimination
Vortioxétine est largement métabolisé principalement par oxydation par le cytochrome P450 isoenzymes CYP2D6, CYP3A4 / 5, CYP2C19, CYP2C9, CYP2A6, CYP2C8 et CYP2B6 et glucuroconjugaison ultérieure. CYP2D6 est la principale enzyme catalysant le métabolisme des vortioxétine à son principal pharmacologiquement inactive, métabolite acide, carboxylique, et les métaboliseurs lents du CYP2D6 ont environ deux fois la concentration vortioxétine plasmatique de métaboliseurs.
Suite à une dose orale unique de [14C] vortioxétine marqué au, environ 59% et 26% de la radioactivité administrée a été récupérée dans l'urine et les fèces, respectivement sous forme de métabolites. Des quantités négligeables de vortioxétine inchangés ont été excrétées dans l'urine jusqu'à 48 heures. La présence d'hépatique (légère ou modérée) ou une insuffisance rénale (légère, modérée, sévère et STIR) n'a pas affecté la clairance apparente de vortioxétine.
Toxicologie Nonclinique
Carcinogenesis, Mutagenesis, Affaiblissement de Fertilité
Carcinogenesis
Les études de cancérogénicité ont été menées dans lesquelles souris CD-1 et des rats Wistar ont reçu des doses orales de vortioxétine jusqu'à 50 et 100 mg / kg / jour pour les souris mâles et femelles, respectivement, et 40 et 80 mg / kg / jour pour les hommes et femmes les rats, respectivement, pendant 2 ans. Les doses dans les deux espèces étaient environ 12, 24, 20 et 39 fois, respectivement, la dose humaine recommandée maximum (MRHD) de 20 mg sur une base mg / m2.
Chez le rat, l'incidence des adénomes polypoïdes bénignes du rectum a été statistiquement significativement augmenté chez les femelles à des doses 39 fois le MRHD, mais pas à 15 fois le MRHD. Ceux-ci ont été considérés comme liés à une inflammation et une hyperplasie et éventuellement causée par une interaction avec un composant du véhicule de la formulation utilisée pour l'étude. La conclusion ne se produit pas chez les rats mâles à 20 fois le MRHD.
Chez les souris, vortioxétine n'a pas été cancérogène chez les mâles ou les femelles à des doses allant jusqu'à 12 et 24 fois, respectivement, le MRHD.
Mutagénicité
Vortioxétine n'a pas été génotoxique dans le test in vitro de mutation inverse bactérienne (test d'Ames) dans une aberration chromosomique in vitro dans les lymphocytes humains en culture, et une vivo osseuse de rat test du micronoyau de moelle osseuse.
Affaiblissement de Fertilité
Le traitement des rats avec vortioxétine à des doses allant jusqu'à 120 mg / kg / jour n'a eu aucun effet sur la fertilité mâle ou femelle, qui est 58 fois la dose maximale recommandée chez l'homme (MRHD) de 20 mg sur une base mg / m2.
Études cliniques
L'efficacité de TRINTELLIX dans le traitement du TDM a été créé en six 6 à 8 semaines randomisée, en double aveugle, études à doses fixes contrôlées par placebo (y compris une étude chez les personnes âgées) et une étude d'entretien chez les patients hospitalisés adultes et externes qui ont atteint le Manuel diagnostique et statistique des troubles mentaux (DSM-IV-TR) les critères de MDD.
Adultes (âgés de 18 ans à 75 ans)
L'efficacité de TRINTELLIX chez les patients âgés de 18 ans à 75 ans a été démontrée dans cinq de 6 à 8 semaines, des études contrôlées par placebo (études 1 à 5 dans le tableau 4). Dans ces études, les patients ont été randomisés pour TRINTELLIX 5 mg, 10 mg, 15 mg ou 20 mg une fois par jour ou un placebo.Pour les patients qui ont été randomisés pour TRINTELLIX 15 mg / jour ou 20 mg / jour, les doses finales ont été titrés à partir de 10 mg / jour après la première semaine.
Les mesures d'efficacité étaient la Hamilton Depression Scale (HAMD-24) score total dans l'étude 2 et l'échelle de dépression de Montgomery-Asberg (MADRS) score totale dans toutes les autres études. Dans chacune de ces études, au moins un groupe de dose de TRINTELLIX était supérieur au placebo dans l'amélioration des symptômes dépressifs, telle que mesurée par la variation moyenne par rapport au départ au point d'extrémité visite sur la mesure d'efficacité primaire .L’analyse des sous-groupes selon l'âge, le sexe ou la race ne suggère aucune preuve claire de la réactivité différentielle. Deux études de la dose de 5 mg aux États-Unis (non représenté dans le tableau 4) n'a pas démontré l'efficacité.
Étude de personnes âgées (âgés de 64 ans à 88 ans)
L'efficacité de TRINTELLIX pour le traitement de TMD a également été démontré dans une, randomisée en double aveugle, contrôlée par placebo, l'étude à dose fixe de TRINTELLIX chez les patients âgés (âgés de 64 ans à 88 ans) avec MDD (étude 6 dans le tableau 4) . Les patients répondant aux critères diagnostiques récurrents MDD avec au moins un précédent épisode dépressif majeur avant l'âge de 60 ans et sans déficience cognitive comorbidité (Mini Mental State Examination score <24) ont reçu TRINTELLIX 5 mg ou un placebo.
Cours Temps de réponse au traitement
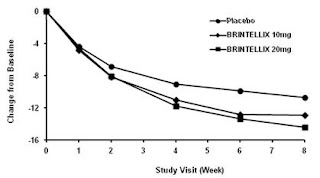
Dans les études contrôlées par placebo 6 à 8 semaines, un effet de TRINTELLIX basée sur la mesure d'efficacité primaire a été généralement observée à partir de la semaine 2 et a augmenté dans les semaines suivantes avec l'effet antidépresseur complète de TRINTELLIX généralement pas vu jusqu'à la semaine d'étude 4 ou plus tard. La figure 4 représente en fonction du temps de réponse aux États-Unis sur la base de la mesure d'efficacité primaire (MADRS) dans l'étude 5.
Figure 4. Changement de référence dans MADRS Score total par visite d'étude (Semaine) dans l'étude 5
Figure 5. Différence par rapport au placebo dans le changement moyen par rapport au départ dans MADRS Score total à la semaine 6 ou Semaine 8
† Résultats (estimation ponctuelle et non ajusté Intervalle de confiance à 95%) sont de modèle mixte pour les mesures répétées (MMRM) d'analyse. Dans les études 1 et 6 l'analyse primaire n'a pas été basée sur MMRM et études 2 et 6 de la mesure d'efficacité primaire n'a pas été basée sur MADRS
.Etude Maintenance
Dans une étude de maintenance non-US (étude 7 sur la figure 6), 639 patients répondant aux critères du DSM-IV-TR pour MDD ont reçu des doses flexibles de TRINTELLIX (5 mg ou 10 mg) une fois par jour au cours d'une 12 semaines ouverte phase initiale de traitement ; la dose de TRINTELLIX a été fixé au cours des semaines 8 à 12. Trois cent quatre-vingt six (396) patients qui étaient en rémission (MADRS score total de ≤10 aux deux semaines 10 et 12) après traitement en ouvert ont été assignés au hasard à la poursuite d'un fixe dose de TRINTELLIX à la dose finale, ils ont répondu à (environ 75% des patients étaient sur 10 mg / jour) pendant la phase ouverte ou un placebo pendant 24 à 64 semaines. Environ 61% des patients randomisés critère de rémission satisfait (MADRS score total ≤10) pendant au moins 4 semaines (depuis la semaine 8), et 15% pendant au moins 8 semaines (depuis la semaine 4). Les patients sur TRINTELLIX ont connu un temps plus long de façon statistiquement significative pour avoir des récidives d'épisodes dépressifs que les patients sous placebo.Récurrence de l'épisode dépressif a été définie comme un score total MADRS ≥22 ou manque d'efficacité en juger par l'enquêteur.
Figure 6. Estimations de Kaplan-Meier de la proportion de patients avec Récurrence (Étude 7)
Comment Fourni / Stockage et manutention
Comprimés TRINTELLIX sont disponibles comme suit:
* Le paquet unité d'utilisation est destiné à être distribuée comme une unité.
Stockage : Conserver à 77 ° F (25 ° C); les excursions permises à 59 ° F à 86 ° F (15 ° C à 30 ° C) [voir contrôlée USP température ambiante].